Глава 3 КРИСТАЛЛЫ: УПОРЯДОЧЕННЫЕ, НО НЕЖИВЫЕ СТРУКТУРЫ
В предыдущей главе упоминалось о том, что повышение температуры связано с более интенсивным движением молекул и, соответственно, приводит к большей неупорядоченности. Это наводит на такую мысль: нельзя ли добиться упорядоченности, избавляя систему от тепловой энергии. Именно это и происходит при охлаждении. Рассмотрим несколько эмпирических фактов. Если заморозить воду, то она превратится в лед, а точнее — образует ледяной кристалл (рис. 3.1).
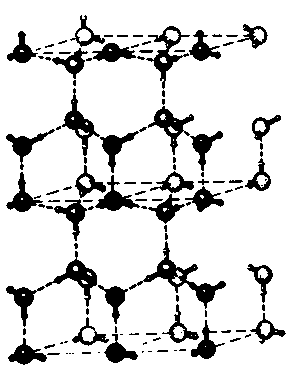
Рис. 3.1. В кристалле льда молекулы воды строго упорядочены и создают периодическую решетку, схематически изображенную на этом рисунке. Большими шарами представлены атомы кислорода, а соединенные с ними сплошными линиями маленькие шарики символизируют атомы водорода
Поскольку молекулы воды очень и очень малы (приблизительно одна миллионная миллиметра), мы не можем увидеть их по отдельности даже при помощи самого лучшего микроскопа, однако кристаллы можно «прощупать», используя рентгеновское излучение или электронные волны, благодаря чему физики и получили столь точную картину их строения. Отдельные молекулы выстроены в кристалле стройными рядами, «плечом к плечу»: здесь мы имеем дело с высокоорганизованным твердым состоянием материи. В жидком состоянии отдельные молекулы воды подвижны относительно друг друга, что и обеспечивает ее текучесть. Если нагреть воду до температуры кипения, она начнет испаряться, т. е. перейдет в газообразное состояние. В водяном паре молекулы воды непрерывно сталкиваются друг с другом и изменяют вследствие этого траектории своего движения, подобно множеству крошечных теннисных мячей — т.е. находятся в состоянии полной неупорядоченности (рис. 3.2).

Рис. 3.2. Три агрегатных состояния воды
В физике эти различные агрегатные состояния — твердое, жидкое и газообразное — называют также фазами, а переходы от одного состояния к другому, соответственно, фазовыми переходами. Благодаря тому, что для возникающих при фазовых переходах состояний характерны совершенно различные уровни упорядоченности (или неупорядоченности), такие переходы давно привлекли к себе внимание физиков; исследования фазовых переходов проводятся и современными учеными. Что же особенного в фазовых переходах?
Как уже ясно из примера с водой, основу каждой из трех фаз — водяной пар, вода и ледяной кристалл — составляют одни и те же молекулы. На микроскопическом уровне эти три фазы отличаются только лишь организацией молекул, их расположением относительно друг друга. В водяном паре молекулы движутся со скоростью около шестисот двадцати метров в секунду, при этом молекулы никоим образом не воздействуют друг на друга (за исключением случаев их столкновения). В жидкости между молекулами существуют силы взаимного притяжения, однако молекулы все же остаются довольно подвижными. В кристаллах же отдельные молекулы жестко упорядочены внутри периодической решетки (рис. 3.3).
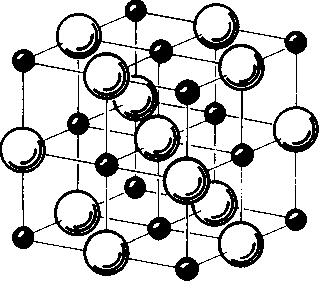
Рис. 3.3. Организация атомов в кристалле поваренной соли (NaCl). Большие шары — ионы хлора, маленькие — ионы натрия
С каждым из этих состояний микроскопической организации связаны совершенно различные макроскопические свойства, особенно же наглядно проявляются различия механических свойств. Например, в газообразной (или парообразной) фазе вещество легко сжимается, в то время как жидкость почти несжимаема, а лед и вовсе является твердым телом. Изменяются и другие физические свойства — к примеру светопроницаемость. Таким образом, мы видим, что микроскопические изменения могут стать причиной появления совершенно новых макроскопических свойств вещества (любого вещества, а не только воды).
Еще об одном свойстве фазовых переходов следует сказать особо. Переходы осуществляются (при прочих постоянных условиях — например неизменном давлении) при совершенно определенной температуре, называемой критической. Допустим, вода закипает при 100°С, а замерзает при 0°С. (Впрочем, температурная шкала Цельсия намеренно устроена таким образом, что отрезок между точкой кипения и замерзания воды равен ста градусам.) Другие вещества плавятся при совершенно других температурах: скажем, железо — при 2081°С, а золото — при 1611°С, и испаряются эти металлы при соответственно более высоких температурах.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК